Mathematische Modellierung in der Biologie
Warum stimmen die Gene von Affen und Mensche zu 98.7 % überein, obwohl beide doch sehr unterschiedlich sind? Welche Faktoren bestimmen die Aktivität von Stoffwechselwegen? Wie kann man die spezifische Bindung von Molekülen an Proteine vorhersagen um damit vielleicht neue Medikamente entwickeln?

Microarray Experiment: Jeder Punkt auf dem Chip gehört zu einem Gen. Aus dem Intensitätsverhältnis von Rot und Grün kann auf die Aktivität eines Gens unter bestimmten Bedingungen geschlossen werden.
Fast alle dieser und ähnlicher Fragen aus der Zellbiologie und Biochemie können bis heute gar nicht oder nur teilweise beantwortet werden. Obgleich mit der Sequenzierung des menschlichen und anderer Genome und mit der Entwicklung neuartiger experimenteller Methoden enorme Fortschritte in den Biowissenschaften erzielt wurden, haben wir das Phänomen Leben bisher kaum verstanden. Die Bedeutung mathematischer Modelle rückt dabei auch durch die immer größere Leistungsfähigkeit der Computer zunehmend in den Vordergrund. Die Analyse molekularbiologischer Daten erfordert die interdisziplinäre Zusammenarbeit von Biowissenschaftlern, Mathematikern und Informatikern. Einige Beispiele dafür sollen im folgenden aufgeführt werden:
Modellierung genetischer und biochemischer Netzwerke
Gene sind Teamarbeiter. Sie arbeiten mit anderen Genen zusammen und können deren Wirkung regulieren. Damit ist es oft nicht einfach, die verschiedenen Funktionen eines Gens oder Proteins zu verstehen oder gar vorherzusagen.
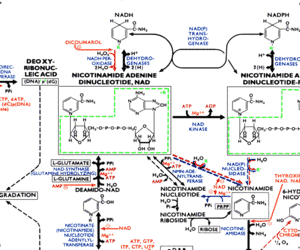
Ein Ausschnit aus einem biochemischen Stoffwechselweg
© 1993 Boehringer Mannheim GmbH - Biochemica
Neuerdings kann man aber beispielsweise mit der Microarray-Technologie, die Aktivität von zehntausend oder mehr Genen parallel messen. Man versucht nun aus diesen Daten mittels statistischer Verfahren ein mögliches Interaktionsnetzwerk zu konstruieren. Ein ähnliches Problem ist die Modellierung von Stoffwechselwegen. Man versucht dabei Vorhersagen über die Änderung bestimmter Stoffkonzentrationen bei einer äußeren Störung zu machen. Eine solche Störung kann beispielsweise durch die Einnahme eines Medikaments verursacht werden und aus dem Modell erhofft man sich Rückschlüsse auf die Ursachen bestimmter Nebenwirkungen.
Sequenzanalyse:
Sequenzmuster aus einem Peptid. Die Abfolge der Aminosäuren ist maßgeblich für die Bindungsaktivität. Wie kann man entscheiden, ob dieses Peptid an ein anderes Molekül bindet oder nicht?
D N F S L H D A L S G
D S S A Y R S V D E V
Die gesamte Erbinformation eines Organismus ist in Form von DNA-Sequenzen gespeichert. Diese Information wird dann über eine Aminosäuresequenz in Proteine umgesetzt, die nahezu alle Lebensvorgänge bestimmen. Die Sequenzanalyse beschäftigt sich damit, aus der DNA- oder Amisäuresequenz auf die Funktion zu schließen. Dazu wurden und werden mathematische Modelle und Algorithmen entwickelt, welche nach Ähnlichkeiten zwischen Sequenzen oder nach bestimmten funktionellen Mustern suchen. Ein Beispiel ist die Vorhersage von Genen in Sequenzen, ein anderes die Vorhersage von Bindungsstellen in einem Protein. Damit verbunden sind interessante mathematische Fragestellungen aus dem Bereich Statistik, Mustererkennung und Algorithmik.

Dreidimensionale Struktur eines Proteins: Die Strukur eines Proteins ist maßgeblich für seine Funktion in Körper. Solche Strukturen mit Computeralgorithmen aus der Sequenz vorherzusagen ist ein Herausforderung der Biomathematik und Bioinformatik.
Alle diesen Problemen erfordern die enge Verknüpfung anspruchsvoller mathematischer Methoden mit praktisch relevanten Fragestellungen. Das Hauptziel ist dabei zum besseren Verständnis der Lebensvorgänge beizutragen, was beispielsweise zur Entdeckung von Krankheitsursachen oder zur Entwicklung von Medikamenten dienen kann.





